菌糸ネットワークは地方分権 ?局所刺激に対する地方限定のシグナル応答を解明?(大学院理工学研究科 豊田正嗣教授 共同研究)
2023/3/10
菌類(カビやキノコ)は、胞子から菌糸と呼ばれる管状の細胞を伸ばして成長し、分岐と菌糸成長を繰り返して、菌糸体と呼ばれる放射状に広がるネットワークを形成します。このネットワークは、水分や栄養を広く行き渡らせるのに適しており、菌類の生存域の拡大、生態系における栄養循環、菌根共生、病原性などにとって重要です。しかしながらこれまで、菌糸ネットワーク内のシグナル伝達を可視化した報告はありませんでした。本研究では、菌糸内のカルシウム濃度変化を蛍光で可視化し、局所的な刺激に応答して菌糸ネットワーク内部でカルシウムシグナルが伝搬する様子を明らかにしました。菌糸内部でのカルシウムシグナルの伝わる範囲がごく狭いこと、刺激を与えた場所でのみ菌糸の成長に遅れが見られたことから、菌糸ネットワークが局所的な反応をしていることが示されました。また、Ca2+受容体を免疫沈降し、質量分析によりその下流の標的を同定しました。局所刺激は、さまざまなシグナル伝達を介して代謝を調節する一方で、菌糸先端の細胞骨格と膜輸送の再編成を通じて、菌糸成長の停止と再開を制御することが示されました。本研究では、脳や神経系のような集中制御系を持たない菌糸ネットワークが、局所的なストレスに応答して、局所限定でカルシウムシグナルが活性化されることにより、地方分権型の応答を示すことを明らかにしました。菌糸ネットワークにおけるシグナル伝達の理解は、菌類が関わる生態学的役割の制御など、バイオテクノロジーへの応用につながると期待されます。
研究代表者
筑波大学 生命環境系
竹下 典男 准教授
東北大学大学院 農学研究科
深澤 遊 助教
埼玉大学 大学院理工学研究科
豊田 正嗣 教授
龍谷大学 農学部植物生命科学科
別役 重之 准教授
研究の背景
菌類(カビやキノコ)は、胞子から菌糸と呼ばれる管状の細胞を伸ばして成長し、分岐と菌糸成長を繰り返すことにより、菌糸体と呼ばれる放射状に広がるネットワークを形成します。その過程で、多くの酵素を細胞外に出して有機物を分解し、栄養を吸収します。そのため、枯れ木や枯れ葉などのバイオマスの分解者として、生態系の物質循環に不可欠な存在です。カビ(糸状菌)の中には、酒?醤油?味噌などの発酵食品の生産に関わるもの、有機酸?有用酵素?抗生物質の生産などバイオ産業で利用されるもの、また、植物の根に共生し、その生長に重要な役割を果たすものもいます。一方で、植物?動物などに感染して病原性を示し甚大な被害をもたらすもの、居住空間?食品などに生えてカビ汚染の原因になったりするものもいます。これら糸状菌の働きは、宿主細胞や基質に菌糸体が吸着し、そこに菌糸を侵入させて生長することで生じます。土壌中に広がる菌糸のネットワークは、栄養や水を広く行き渡らせるのに適しており、その物流能力は、菌類の生存域の拡大、生態系における栄養循環、菌根共生、病原性などにとって重要です。しかしながら、これまで、このような菌糸ネットワークにおけるシグナル伝達を可視化した報告はありませんでした。
研究内容と成果
本研究では、菌糸内のカルシウムイオン濃度の変化を蛍光で可視化することで、局所的な刺激に応答して菌糸ネットワーク内部でカルシウムシグナルが伝搬する様子を明らかにしました(図A)。直径が数cmの糸状菌のコロニーの周辺の一部をナイフで切断する、あるいはNaClやエタノールを1μl滴下して刺激を与え、その際のカルシウムイオンの蛍光シグナルを顕微鏡で観察しました(図B)。菌糸内部でのカルシウムシグナルの伝わり方は、刺激の種類やそこからの距離によって変化しますが、いずれの刺激に対しても、シグナルは1.5 mm程度の範囲内にしか広がりませんでした。このことから、菌糸ネットワークが局所的な反応をしていることが示唆されました。また、刺激を与えた場所でのみ、菌糸の成長の遅れが見られました(図C、D)。
次に、レーザー照射による局所刺激を用いて、菌糸1細胞内におけるカルシウムシグナルの伝搬を解析しました。レーザーを菌糸先端に照射すると、菌糸先端から後方に向かってカルシウムの蛍光シグナルが流れる様子が繰り返し観察されました。カルシウムシグナルの発生回数や間隔は、レーザー強度によって変化し、さらに、各菌糸先端のアクチン細胞骨格と膜輸送の再編成を通じて、菌糸成長の停止と再開を制御することが分かりました。
次に、カルシウムシグナルの役割を明らかにするために、細胞内カルシウムイオン受容体であるカルモジュリン注1)とカルモジュリン依存性タンパク質リン酸化酵素を免疫沈降注2)し、質量分析により相互作用するタンパク質を網羅的に明らかにすることで、その下流の標的候補を同定しました。これにより、膜輸送、シグナル伝達、糖?アミノ酸代謝、ミトコンドリアなどが関与する細胞内での応答が示されました(図E、F)。
これらのことから、脳や神経系のような集中制御系を持たない菌糸ネットワークは、局所的なストレスに応答し、局所的に活性化されたカルシウムシグナルを介して菌糸細胞内の標的タンパク質の活性を制御?応答し、地方分権型の応答を示すことが明らかにされました。
今後の展開
菌類の働きは、バイオマスの分解や動植物への寄生?共生、発酵などに関わることから、菌糸ネットワークにおけるシグナル伝達を理解することは、菌類が関わる生態学的役割の制御など、農業、バイオテクノロジー分野への応用につながると期待されます。
参考図
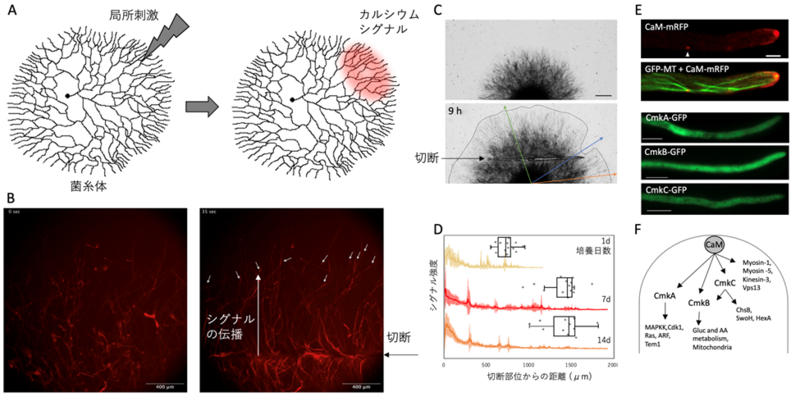
図 (A) 菌糸体に局所刺激を与えた際、カルシウムシグナルは局所的に広がることを示したイメージ図。(B)菌糸体を切断した時のカルシウムシグナル伝播の蛍光画像。(C) 菌糸体を切断した時、菌糸先端付近が切断された場所でのみ、菌糸の成長が遅れる。(D) 培養日数が1, 7, 14日の菌糸体コロニーを切断した際にカルシウムシグナルが伝播する距離。(E) 赤?緑色蛍光で標識されたカルモジュリン(CaM)と微小管。緑色蛍光で標識された3つのカルモジュリン依存性タンパク質リン酸化酵素 (CmkA, CmkB, CmkC)は細胞質に存在する。(F) CaM, CmkA, CmkB, CmkCの標的タンパク質と応答。
用語解説
注1)カルモジュリン
カルシウムイオンは細胞内に豊富に存在し、シグナル伝達に不可欠な役割を果たす。カルモジュリンは、細胞内カルシウムイオンの主要な受容体で、濃度依存的にカルシウムイオンと結合することで活性化し、さまざまなタンパク質に結合することで、それらの機能を制御する。カルモジュリン依存性タンパク質リン酸化酵素も、カルモジュリンとの結合で活性化し、さまざまな標的タンパク質をリン酸化することでそれらの機能を制御する。
注2)免疫沈降
抗原と抗体の親和性を利用して、溶液中から抗原を特異的に分離?精製する方法。ここではGFP融合タンパク質にGFP抗体を用いて標的タンパク質を精製する。その際、標的タンパク質と相互作用するタンパク質も精製される。
研究資金
本研究は、科研費(基盤B:21H02095)、新学術ポストコッホ生態、大隅基礎科学創成財団の助成、および、科学技術振興機構(JST) 戦略的創造研究推進事業 総括実施型研究(ERATO)「野村集団微生物制御プロジェクト」の一環として行われました。
掲載論文
| 題名 | Local calcium signal transmission in mycelial network exhibits decentralized stress responses (菌糸体ネットワークにおける局所的なカルシウムシグナル伝達がストレス応答の分散化を示す) |
|---|---|
| 著者名 |
Ayaka Itani1#, Shunsuke Masuo1#, Riho Yamamoto1, Tomoko Serizawa1, Yu Fukasawa2, Naoki Takaya1, Masatsugu Toyota3,4,5, Shigeyuki Betsuyaku6, Norio Takeshita1* 1 Microbiology Research Center for Sustainability (MiCS), Faculty of Life and Environmental Sciences, University of Tsukuba, 305-8572, Japan 2 Graduate School of Agricultural Science, Tohoku University, Miyagi, 989-6711, Japan 3 Department of Biochemistry and Molecular Biology, Saitama University, Saitama, 338-8570, Japan 4 Suntory Rising Stars Encouragement Program in Life Sciences (SunRiSE), Kyoto, Japan 5 Department of Botany, University of Wisconsin-Madison, Madison, WI 53706, USA 6 Department of Plant Life Science, Faculty of Agriculture, Ryukoku University, Shiga, 520-2194 Japan #Equal contribution *Corresponding author |
| 掲載誌 | PNAS Nexus |
| 掲載日 | 2023年3月7日 |
| DOI | 10.1093/pnasnexus/pgad012 |
参考URL


