希少金属ニッケルを生物の色素体に利用する酵素!?-古細菌特有のニッケルキラターゼ酵素CfbAの仕組み-(大学院理工学研究科 ?藤城貴史准教授)
2021/1/8
埼玉大学大学院理工学研究科の藤城貴史准教授の研究グループは、古細菌に特有の環状テトラピロール型色素体であり、希少金属であるニッケルを構成要素とする「補因子F430」を生合成する酵素CfbAの仕組みを明らかとしました。
本研究グループは、酵素の立体構造を分子?原子レベルで明らかとするX線結晶構造解析と呼ばれる手法を用いて、CfbAが補因子F430を作るための材料(前駆体)であるシロヒドロクロリン(sirohydrochlorin)にニッケルイオン(Ni2+)を結合させる触媒反応(図1)を可視化することに成功しました。また、コバルトイオン(Co2+)を用いた場合についても同様の実験を行い、Ni2+とCo2+のCfbAへの結合の仕方が、分子レベルで異なることを見出しました。
補因子F430の生合成を担うCfbAは「II型キラターゼ」と呼ばれる酵素群に属し、それらの中でも進化的に古い"祖先型"として知られています。一方、この酵素群に含まれる"子孫型"キラターゼもまた、様々な生物色素体の生合成を行なっており、例えば、フェロキラターゼは赤血球の鉄を含む赤色色素「ヘム」などの生合成、コバルトキラターゼは「ビタミンB12」の生合成を担っています。したがって、本研究成果は、各種II型キラターゼ酵素が、祖先型CfbAから様々な変異によって"分子進化"することにより、それぞれ独自の金属イオン選択性を獲得し、その結果として、生物が多様な生物色素体を獲得?利用するようになった過程に関する重要な知見を与えるものです。
また、本成果を参考に、CfbAそのものを触媒として利用する方法や、CfbAの反応の仕組みを模倣した反応により、補因子F430型の新規なニッケル触媒の開発も期待できると考えられます。
本成果は、2021年1月4日に、英国王立化学会雑誌『Chemical Science』に、Advance article(オンライン速報)として公開されました。
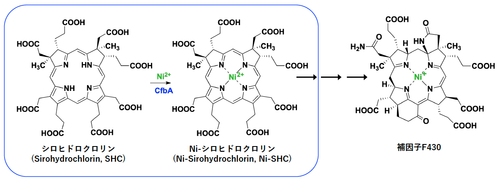
図1. 補因子F430の生合成系におけるCfbAによるニッケルイオンのシロヒドロクロリンへの挿入反応(上図、青枠)。
ポイント
?希少金属であるニッケルを利用する珍しい色素体「補因子F430」の生合成の鍵となるCfbA酵素が、どのようにニッケルを利用するか、その仕組みは不明でした。
?X線結晶構造解析により、CfbAの基質(ニッケル、シロヒドロクロリン)結合型、反応中間体型、生成物(Ni-シロヒドロクロリン)結合型の構造を明らかとし、CfbAによる触媒反応の仕組みを解明しました。
?CfbAを含め、「II型キラターゼ」と呼ばれるグループに含まれる酵素は、それぞれが異なる金属イオンを利用し、様々な金属を含む生物色素体の生合成を行なっていますが、本結果により、「II型キラターゼ」酵素群の分子進化の道筋や、様々なII型キラターゼ酵素の金属選択性の比較?検討が可能になります。
?また、本研究で明らかにしたCfbAの触媒反応に関する知見は、補因子F430型の新規なニッケル触媒の設計?開発へと利用できるかもしれません。
研究の背景
生物は、様々な色素体を利用しますが、その中でも金属を含む環状テトラピロール型色素体は、生命活動維持に重要な分子群として知られています。例えば、赤血球の赤色色素である「ヘム」や、植物の光合成で働く緑色色素「クロロフィル」、必須栄養素であり末梢神経障害の治療薬としての利用が知られる「ビタミンB12(コバラミン)」が有名です。その中でも、生物色素体の一つである「補因子F430」は、生物界の三つのドメイン(真核生物?原核生物?古細菌)のうち、古細菌にのみ見られるユニークな色素体であることが知られています。補因子F430は、古細菌のメタン発生や分解に利用されており、地球の炭素循環において非常に重要な成分です。
驚くべきことに、補因子F430は、通常、生物にとって有害でほとんど利用されない希少金属"ニッケル"を構成成分としています。ごく最近、補因子F430の生合成に関わる酵素群の研究が行われ、ニッケルを利用する酵素としてCfbAが同定されました。この生合成系では、まず出発物質であるシロヒドロクロリン(sirohydrochlorin)が、Ni2+を用いたCfbAによりニッケル-シロヒドロクロリンに変換され、さらに数段階の酵素反応により補因子F430に変換されることがわかっています。すなわち、CfbAは、補因子F430の材料(前駆体)であるシロヒドロクロリンに、ニッケルイオン(Ni2+)を結合させる補因子F430の生合成系で最も重要な酵素です(図1)。しかしながら、これまで酵素CfbAが、どのようにニッケルを利用するかについて、その仕組みは不明でした。
研究成果
本研究グループは、酵素の立体構造を分子?原子レベルで調べることができるX線結晶構造解析という手法により、CfbAの基質(Ni2+、シロヒドロクロリン)結合型、反応中間体型、生成物結合型の構造をそれぞれ明らかとしました(図2、図3)。
ニッケル結合型CfbAの立体構造を見ると(図2)、二つのサブユニットが対称的に組み合わさり、会合面にポケットのような空洞を作っています。このポケットには、Ni2+を結合するアミノ酸残基であるHis9, His75, Glu42が存在していました。またシロヒドロクロリンも、このポケットに1分子結合することがわかりました(図3)。したがって、このポケットがCfbAの酵素反応を行う活性部位であることがわかりました。
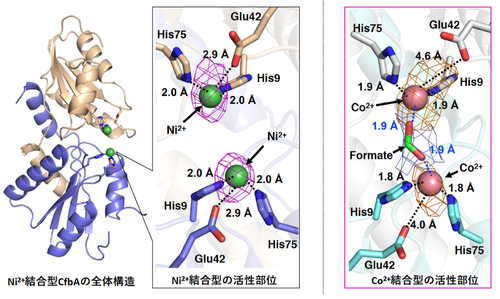
図2. CfbAの全体構造と活性部位の構造。同じ2つのポリペプチドの折り畳みからなるタンパク質サブユニット(薄茶色、紺色リボン図)が二量体を作っている。Ni2+は緑色、Co2+はピンク色の球で表示している。金属イオンの結合の仕方(特にGlu42と溶媒由来のformate =ギ酸イオンの有無)に違いが見られる。なおNi2+の場合にも、結晶化の際に用いた溶媒にギ酸イオンは含まれている。
次に、シロヒドロクロリンを結合した状態のCfbAの結晶にNi2+を添加することで、"結晶内でのCfbAによる酵素反応"を行いました。これにより、CfbAの結晶内に生成した"反応中間体"のX線結晶構造解析が可能となります。その結果、Ni2+とシロヒドロクロリンが同時にCfbAの活性部位のポケットに結合した構造が得られました(図3)。興味深いことに、反応前にはGlu42のカルボキシ基がNi2+に結合していましたが、反応中間体ではGlu42のカルボキシ基はNi2+から外れて、代わりに、シロヒドロクロリンの環の側面のカルボキシ基と置き換わっていました。これらの構造から、CfbAの触媒機構を提示しました(図3、図4)。CfbAは、まずシロヒドロクロリン、続いてNi2+を結合します(図4左)。その際に、Glu42から基質シロヒドロクロリンへ、Ni2+に結合したカルボキシ基が交換することより、シロヒドロクロリンに環の歪み(反り)を促します。これによって、Ni2+-His9-His75-カルボキシ基複合体と反対側にあるHis9-His75-Ni2+からNi2+が除かれ、残されたHis9, His75によるシロヒドロクロリンの中央の穴のNH基の脱プロトン化反応が促進されます(図4右)。この脱プロトン化によって、残ったNi2+-His9-His75-カルボキシ基複合体のNi2+が、シロヒドロクロリンの中央の穴に挿入され、反応が完結します。
以上のように、本研究では、反応物であるシロヒドロクロリンが、自分自身のカルボキシ基を利用して、ニッケルを取り込むような形で、反応を促進するCfbAの触媒メカニズム(仕組み)を提唱することができました。また、生成物(Ni-シロヒドロクロリン)の結合型CfbA の構造も、このメカニズムを支持しています。
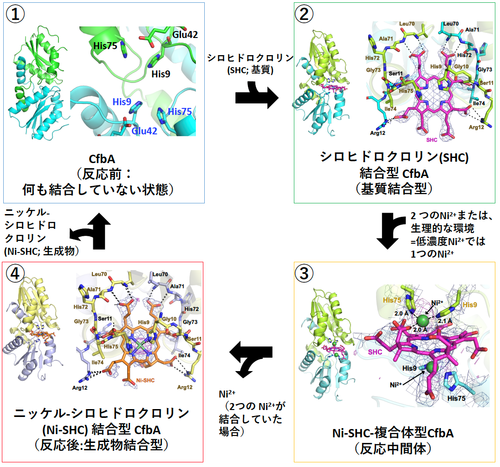
図3. 本研究で決定したCfbAの触媒反応の各段階のX線結晶構造と触媒反応サイクル。①、②、③、④の順に触媒反応が段階的に進行する。
SHC:シロヒドロクロリン(反応基質)、Ni-SHC: (ニッケルシロヒドロクロリン(生成物)を表す。
一方、コバルト(Co2+)を用いた場合にも (図2)、ニッケル(Ni2+)と同様の触媒反応が進行することがわかりました。ただし、Co2+とNi2+は、その触媒活性や反応前の結合の仕方が異なっていました。今後は、このような違いが生まれる理由を明らかにするため、今回得られた構造を用いて、計算化学などの手法により研究を進めていく予定です。
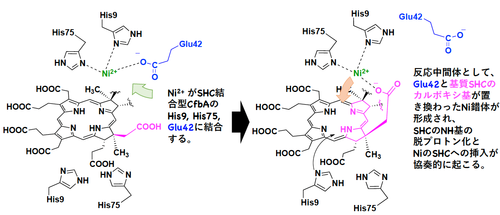
図4. CfbAの活性部位における、NiがSHCに挿入される推定触媒機構。
まとめと今後の展開
CfbAを含め、「II型キラターゼ」と呼ばれるグループに含まれる酵素は、様々な金属を含む生物色素体(例:補因子F430、ヘム、ビタミンB12)の生合成において重要であり、それぞれ異なる金属イオンやシロヒドロクロリン様の分子を基質として利用しています。例えば、フェロキラターゼはFe2+を用いてヘムの生合成を行い、コバルトキラターゼはCo2+を用いてビタミンB12の生合成を行います(図5、図6)。すなわち、II型キラターゼが、広く生物にとって重要な酵素群であることは明らかです。
では、なぜ生物は進化の過程で様々なII型キラターゼを生み出し、多様な生物色素体を生合成?利用するようになったのでしょうか?本研究結果は、この問いに答えを出すべく、「最も祖先型であるCfbAを起点としたII型キラターゼ酵素群の分子構造の進化と、それらの多様な機能の発現」について、それぞれのII型キラターゼ酵素の構造の違いに基づく、分子?原子レベルでの理解が進むと考えられます。
また、本研究で明らかにしたCfbAの触媒反応に関する知見は、補因子F430型の新規なニッケル触媒の設計?開発へと利用できるかもしれません。古細菌は、補因子F430を利用してメタンの生産?分解を行なっており、今回得られた知見を参考にした新規なニッケル触媒の開発も期待されます。
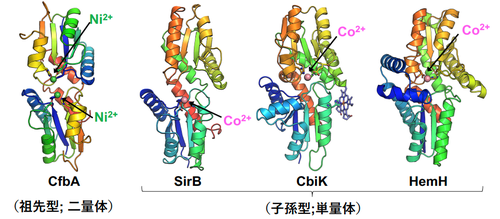
図5. 祖先型のCfbAと子孫型の各種II型キラターゼの立体構造の比較. 酵素のポリペプチド(リボン図)を、そのN末端側からC末端側にかけて、青→緑→黄色→赤へと色で示している。
原論文情報
掲載誌:Chemical Science
論文名:The nickel-sirohydrochlorin formation mechanism of the ancestral class II chelatase CfbA in coenzyme F430 biosynthesis
(補因子F430の生合成系における祖先型のII型キラターゼCfbAによるニッケル-シロヒドロクロリン形成機構)
著者名:Takashi Fujishiro, Shoko Ogawa
DOI: 10.1039/D0SC05439A
用語解説
1. 環状テトラピロール型色素体
生物が生命活動維持に利用する非アミノ酸性の必須微量成分のうち、4つのピロールと呼ばれる有機分子をつながって環構造をとる分子群の総称。環構造の中心に、4つのピロールの窒素(NまたはNHの状態)からなる"穴"があり、様々な金属イオンをその穴に結合させた「金属イオンを含む環状テトラピロール」が有名である。例として、赤血球の赤色色素であるヘム(鉄を持つ)や、ビタミンB12(コバルトを持つ)が、特によく知られる(図5)。
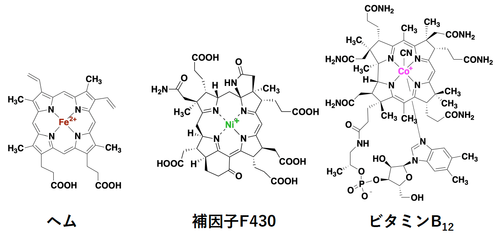
図6. 金属を含む環状テトラピロール型色素体の例
2. 補因子F430
メタン代謝を行う古細菌のみが有する特殊な環状テトラピロール型色素体。中心に希少金属であるニッケルを結合し、メタン代謝を行う古細菌のメタンの生産や分解に用いられる。
3. CfbA
本研究対象とした酵素であり、補因子F430の生合成過程において、その材料であるテトラピロール型色素体の一種「シロヒドロクロリン」に、Ni2+を結合させる反応を触媒する。
4. II型キラターゼ
補因子F430を生合成するCfbAや、ヘムを生合成するフェロキラターゼ、ビタミンB12を生合成するコバルトキラターゼなどの、金属イオンと環状テトラピロール型分子を基質として、金属結合型環状テトラピロールを合成可能な酵素グループの総称。他にもI型とIII型キラターゼが知られるが、II型のものが最も多くの種類があり、かつ、最もよく研究が進められている。
5. 基質
一般に酵素反応において、化学反応を触媒される物質、反応物。
6. 古細菌
生物の分類学において、最初に分けられる三つのグループのうちの一つ。他の二つのグループに、原核生物と真核生物がある。古細菌に属する生物は、ヒトにとっての極限環境(例:高温、高塩濃度、無酸素条件など)に生息するもの(微生物)が多い。
7. X線結晶構造解析
タンパク質などの生体高分子の立体構造を分子?原子レベルで決定する手法の一つ。対象とする生体高分子の結晶を作成し、X線を照射することで回折像を取得、それらの像を計算処理することにより、その立体構造を明らかにすることができる。
8. シロヒドロクロリン
補因子F430の生合成の材料(前駆体)として用いられる環状テトラピロール型の分子。CfbAの酵素反応の基質である。シロヒドロクロリンは、まずCfbAにより、ニッケル-シロヒドロクロリンに変換され、さらに数段階の酵素反応により補因子F430にまで変換される(図1)。
9. カルボキシ基
有機化学において、COOHで表される構造体(官能基)。細胞内部のような水溶液の環境では、イオン化したCOO-の状態とCOOHの状態が平衡にある。また、金属イオンに結合する性質も知られており、金属を利用するタンパク質では、しばしば金属結合部位に見られる構造体である。
研究支援
科学研究費補助金 新学術領域研究「生合成リデザイン」 19H04639
参考URL
【プレスリリース】希少金属ニッケルを生物の色素体に利用する酵素!?-古細菌特有のニッケルキラターゼ酵素CfbAの仕組み-![]()


